- Accueil
- L’association
- Pourquoi Birmania and Co ?
- Bureau et infos
- Chartes
- Adresses des éleveurs
- Demande de diplôme
- Demande d’affixe
- Adhésion
- Spéciales d’élevage
- RESULTATS SPECIALE D’ELEVAGE SACRE DE BIRMANIE 26 NOVEMBRE 2023
- RESULTATS SPECIALE D’ELEVAGE SACRE DE BIRMANIE 13 FEVRIER 2022
- RESULTATS SPECIALE D’ELEVAGE SACRE DE BIRMANIE 12 MAI 2019
- RESULTATS SPECIALE D’ELEVAGE SACRE DE BIRMANIE 18 NOVEMBRE 2018
- RESULTATS SPECIALE D’ELEVAGE SACRE DE BIRMANIE 1ER OCTOBRE 2017
- RESULTATS SPECIALE D’ELEVAGE SACRE DE BIRMANIE 5 NOVEMBRE 2017
- RESULTATS SPECIALE DE RACE LILLE 11 DECEMBRE 2016
- RESULTATS SPECIALE DE RACE LILLE 13 DECEMBRE 2015
- Nos magazines
- Le Birman
- Autres races
- Soins et santé
- Les maladies
- Allergies du Chat
- L’alopécie
- Les antiparasitaires
- La bordetellose
- Calicivirose féline
- La Cardiomyopathie hypertrophique
- Chlamydiose
- Directives de vaccination des chiens et des chats
- Epilepsie
- Giardiose
- Hemobartonella feline
- Herpès félin
- Hypervitaminose
- Infertilité du chat
- La leucose féline
- La Rage
- La teigne
- La vaccination
- Maladies génétiques
- La metrite
- Monorchidie
- Pathologie en collectivité
- La PIF
- La PKD
- Conférences
- Génétique
- Les groupes sanguins chez les chats
- Recensement groupe sanguin
- Groupe AB
- La génétique des couleurs chez le chat
- Tares génétiques
- Tares génétiques – Défaut reproduction birman
- Les autres alopécies généralisées héréditaires
- Morphologie du chat
- Les tests de résistance à la péritonite infectieuse féline (FIPR)
- Lexique
- Identification génétique
- Du phénotype à la biologie moléculaire – couleur chat
- Le gène O
- Génétique couleur – Gène b et dilution
- Consanguinité
- Le gene I
- Les robes félines les motifs tabby
- Comportement
- Le comportement maternel
- Chats : quand rien ne va plus
- Le deuil et le chat
- Fleurs de Bach le Châtaigner
- Folie avérée
- L’intelligence du chat
- Le chat d’appartement et les doudous
- Le chat et la hiérarchie
- Le chat étranger comprend t-il notre langue ?
- LE PICA
- Le sevrage psychosocial : kézako ?
- Les fleurs de Bach
- Le marquage territorial
- Témoignage comportement
- Le chaton
- Choisir un chaton de race
- Gestation et mise bas
- Premières heures de vie : les gestes à faire
- Préparer la mise bas : un moment privilégié
- Stérilisation précoce
- La pathologie néonatale du chaton
- Intérêts de la pesée
- Donner un médicament
- Falbala de Beit Shemesh
- Le tremblement chez le chaton nouveau-né
- Point et température
- Formalités
Le nude
Description du phénotype du syndrome de nudité du Sacré de Birmanie
1. Aspect phénotypique de l’alopécie héréditaire généralisée du Birman
En 1978, Peter Hendy-Ibbs décrivit le premier un chaton né nu dans une portée de quatre chatons de race Sacré de Birmanie en Grande Bretagne. Les trois autres chatons ainsi que les parents présentaient un phénotype normal. Il a rapporté que neuf chatons Birmans nus étaient nés de la même lignée dans les quatre années suivantes, portant le nombre de chatons nus à dix parmi vingt-cinq chatons nés. En 1986 en France puis en 1994 en Suisse, des chatons Birmans nus ont été présentés en consultation puis suivis sur plusieurs mois à École vétérinaire d’Alfort (Bourdeau et al., 1988 ; Casal et al., 1994).
Tous ces chatons présentaient un phénotype similaire avec une peau nue plissée (Figure 4), en particulier au niveau de la tête, conservant la pigmentation typique du Sacré de Birmanie (colourpoint et ganté de blanc) (Hendy-Ibbs, 1984). Les poils de jarre étaient absents et seul un léger duvet d’aspect laineux était présent sur la partie supérieure du corps, les parties déclives restant totalement glabres. Les poils étaient courts, moins de 5 mm, et formaient un feutrage fragile. Les vibrisses (moustaches et cils) étaient présentes mais courtes et souvent réduites à une simple boucle.
Figure 4. Phénotype d’un chaton Sacré de Birmanie de quatre mois atteint du syndrome de nudité
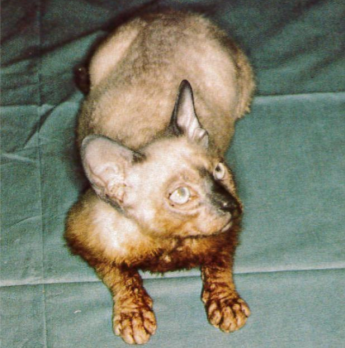
La peau, qui conserve le patron de couleur typique du birman, est plissée et couverte d’un fin duvet laineux. Notez l’accumulation de sécrétions jaunâtres au niveau des membres antérieurs.
Source : Bourdeau et al., 1988
Une atteinte des griffes a été rapportée dans quelques cas (Bourdeau et al., 1988). Dans ces cas, les griffes étaient présentes mais minces, molles et fragiles à deux mois puis légèrement plus dures à quatre mois (Figure 5). Tous les chatons présentaient une accumulation de productions kérato-séborrhéiques de couleur jaunâtre à brunâtre dans les plis de la peau et en particulier entre les doigts. De plus ils se salissaient vite et dégageaient une forte odeur motivant les propriétaires à les laver régulièrement. Une atrophie des papilles cornées linguales a également été rapportée (Bourdeau et al., 1988) mais tous les auteurs ont noté une dentition normale (Bourdeau et al., 1988 ; Casal et al., 1994 ; Hendy-Ibbs, 1984).
Figure 5. Aspect des griffes d’un chaton birman atteint du syndrome de nudité
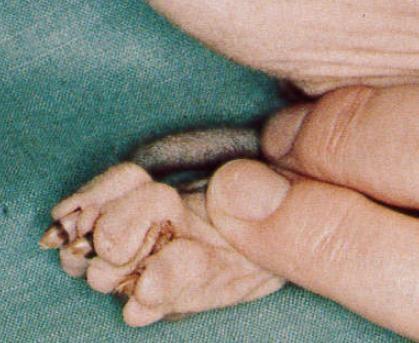
Notez l’atrophie de la gaine cornée des griffes.
Source : Bourdeau et al., 1988
2. Aspect histo-pathologique de la peau et des poils
Le fin duvet présent sur le dos des chatons était formé de poils courts, tordus voire cassés et s’épilant facilement. Le trichogramme réalisé sur les chatons a montré des poils clairement anormaux avec des racines élargies en cloche et peu kératinisées. L’aspect était pâle à transparent en microscopie optique. La structure même du poil était anormale avec une perte de distinction entre la cuticule, la corticale et la medulla, ce qui donnait au poil un aspect irrégulier et cassé (Figure 6). L’extrémité distale du poil était également anormale, elle n’était plus conique, mais arrondie ou carrée sans être cassée.
Figure 6. Détail de la structure d’un poil d’un chaton Birman atteint du syndrome de nudité
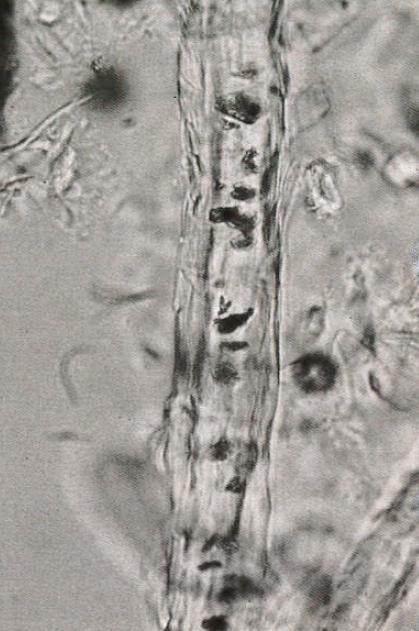
La surface du poil est irrégulière, notez l’absence de distinction entre les différentes structures (cuticule, cortex et medulla).
Source : Bourdeau et al., 1988
La biopsie cutanée a révélé un épiderme acanthosique avec jusqu’à deux assises cellulaires supplémentaires avant la couche granuleuse. La couche cornée présentait une hyperkératose orthokératosique avec des plis comblés de matériel kératoséborrhéique (Lefort, 2011).
Les follicules pileux étaient peu nombreux (Casal et al., 1994), atrophiés avec une structure de cuticule, corticale et medulla non conservée. La gaine épithéliale interne du poil était déformée par de grosses granulations de kératohyaline dans la couche de Huxley.
Les structures sébacées n’étaient pas modifiées mais une réduction du nombre de glandes sudoripares apocrines a parfois été rapportée (Casal et al., 1994).
Les modifications du derme se limitaient à un aspect très légèrement inflammatoire en partie superficielle avec quelques infiltrats cellulaires périvasculaires (Bourdeau et al., 1988).
3. Autres lésions observées chez les chatons Sacré de Birmanie nus
Les chatons avaient une activité et une croissance normales mais présentaient une mortalité précoce (entre 10 semaines et 8 mois) secondaire à des infections pulmonaires ou digestives (Bourdeau et al., 1988 ; Hendy-Ibbs, 1984). Cette sensibilité accrue aux infections pourrait être expliquée par l’absence de thymus rapportée à l’autopsie (Casal et al., 1994). À l’emplacement du thymus se trouvait du tissu conjonctif et graisseux, l’analyse histologique a montré l’absence de parenchyme thymique ou de corpuscules de Hassal. Les tissus lymphoïdes (nœuds lymphatiques, pulpe blanche de la rate, Mucosal Associated Lymphoid Tissues (MALT) dont les plaques de Peyer) étaient également modifiés : le nombre de follicules germinaux était réduit et les zones para-corticales étaient pauvres en lymphocytes T (Casal et al., 1994).
C- La mutation responsable du syndrome nude chez le Sacré de Birmanie – connaissances actuelles
Remarque : le terme nude utilisé dans les paragraphes suivants renvoie à un syndrome, dans ce cas il sera écrit en roman ; ou à une mutation, dans ce cas il sera écrit en italique. Pour faciliter l’écriture, l’adjectif nude qualifiant le phénotype des souris atteintes du syndrome sera accordé, même s’il s’agit d’un terme anglo-saxon à l’origine.
1. Mode de transmission
En 1984, l’analyse des pédigrées des chatons Birmans nus britanniques a fait suspecter une mutation monogénique à transmission récessive et a permis de remonter à une chatte Sacré de Birmanie française importée en Grande-Bretagne, pouvant être à l’origine de la transmission d’une mutation causale dans la lignée étudiée (Hendy-Ibbs, 1984). Une transmission autosomique récessive a également été mise en évidence par Casal en 1994 après étude d’une lignée montrant neuf chatons nus nés de parents Sacré de Birmanie (Casal et al., 1994).
En 2013, un chaton mâle Birman nu issu d’une portée de cinq chatons a été présenté en consultation de génétique à l’École nationale vétérinaire d’Alfort (Figure 7). Ce chaton partageait les caractéristiques physiques des chatons Birmans nus britanniques et est décédé à quatre mois d’une diarrhée sévère. Les parents et les autres chatons de la portée présentaient un phénotype normal, cependant la lecture du pédigrée de la mère a montré une relation avec un mâle Birman ayant également produit un chaton femelle Birman atteinte du même syndrome. Un ancêtre commun né en 1977 a été trouvé, de plus ce chat était connu par les éleveurs pour avoir produit des chatons nus. L’analyse des pédigrées de la lignée étayait l’hypothèse d’une transmission autosomique récessive pour ce syndrome de nudité associé à une mortalité précoce (Abitbol et al., 2015).
Figure 7 : Phénotype des chatons Birmans nus
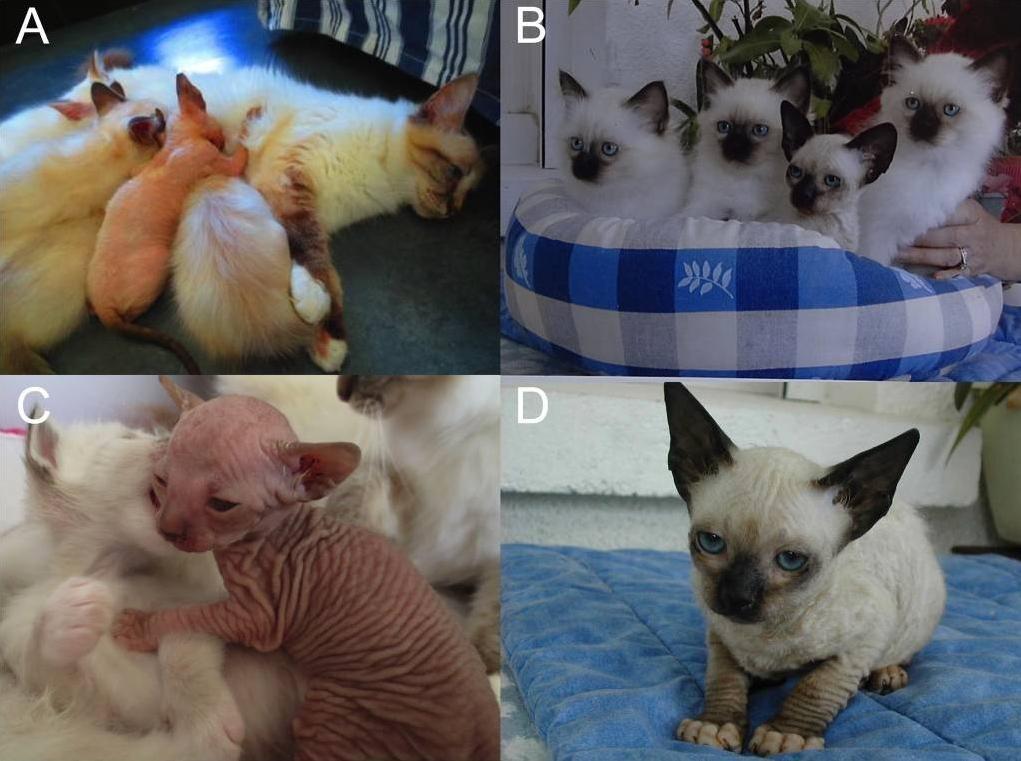
A et B : chatons Birmans nus parmi leurs portées, notez le phénotype normal des autres chatons et de la mère. C : chaton Birman nu mâle de 3 semaines. D : chaton Birman nu femelle de 12 semaines, notez l’absence de pelage mais la présence du patron de couleur standard du Birman.
Source : Abitbol et al., 2015
Mise en évidence d’une mutation dans le gène FOXN1 chez le Sacré de Birmanie
L’amplification et le séquençage des huit exons du gène forkhead box N1 (FOXN1) chez le chaton vu en consultation de génétique et chez son père et la comparaison avec la séquence de référence a mis en évidence la présence de sept polymorphismes de type SNPs (Single Nucleotide Polymorphism) et une délétion de quatre paires de bases. Il a été établi que cinq de ces SNPs étaient des mutations synonymes et deux, des mutations non-synonymes n’affectant pas la fonction de la protéine FOXN1. La délétion des quatre paires de bases CTGT en position 1030 dans l’exon 6 de FOXN1 a été identifiée comme étant à l’origine de l’apparition d’un codon stop en position 547 dans la protéine. Cette délétion a été retrouvée à l’état homozygote chez le chaton mâle nu et hétérozygote chez la mère, le père et les autres chatons normaux de la portée ainsi que chez le père et le grand-père de la femelle atteinte. Cette répartition était en concordance avec l’hypothèse de transmission autosomique récessive du syndrome. Il a été déduit que la délétion de quatre paires de bases dans l’exon 6 du gène FOXN1 était à l’origine du syndrome de nudité du Sacré de Birmanie (Abitbol et al., 2015).
I. LA MUTATION NUDE
Le gène FOXN1, où a été située la mutation à l’origine du syndrome de nudité du Sacré de Birmanie, est impliqué dans un syndrome similaire chez la souris. Ce syndrome associe une alopécie, une athymie et une mortalité précoce et est causé par la mutation nude.
A- Premières observations des mutants nudes chez la souris
En 1966, Flanagan fut le premier à observer un mutant sans poil apparu de façon spontanée dans sa colonie de souris albinos. Il attribua le nom de nude à cette mutation en comparaison avec une autre mutation produisant un phénotype nu, la mutation hairless. Utilisant deux souris de phénotype sauvage qu’il supposa être hétérozygotes pour la mutation nude il pu établir une colonie de souris nues, il en déduisit que la transmission de la mutation était autosomique récessive. Certaines caractéristiques des souris nudes compliquèrent la mise en place de la colonie, en effet ces souris souffraient d’un défaut de comportement maternel et d’infertilité, les ovaires comptaient peu de follicules et les spermatozoïdes étaient peu mobiles (De Sousa et al., 1969 ; Flanagan, 1966 ; Pantelouris, 1973).
L’examen histologique lui appris que, normaux à la naissance, les follicules pileux se tordaient et s’enroulaient dans l’infundibulum pilaire à partir du sixième jour de vie, ne réussissant pas à pénétrer la barrière épidermique. Flanagan émis l’hypothèse d’un défaut de kératinisation du poil et la déficience en groupement sulfuhydryle de la tige pilaire qu’il pu mettre en évidence supporta son hypothèse (Flanagan, 1966). Les souris nudes présentaient également une mortalité précoce secondaire à une immunodéficience sévère. C’est Pantelouris qui mis en évidence une absence de thymus et une leucopénie chez les mutants nudes, pouvant expliquer cette immunodéficience (Pantelouris, 1968).
B- Phénotype associé à la mutation nude chez la souris
1. Nudité et développement anormal des follicules pileux
Rappelons tout d’abord la structure d’un follicule pileux normal dans la Figure 13. Le follicule pileux est divisé en trois régions : l’infundibulum ouvert sur l’extérieur par l’ostium pilaire, l’isthme où s’abouche la glande sébacée et le bulbe. La tige pilaire est composée, de l’intérieur vers l’extérieur, de la medulla, du cortex et de la cuticule. La medulla est constituée de cellules vacuolaires. Le cortex est constitué de cellules mortes formant la partie kératinisée et pigmentée du poil. Enfin, la cuticule est une assise monocellulaire de cellules mortes et aplaties : les cornéocytes. Jusque dans la région de l’isthme, la tige est entourée par une gaine épithéliale interne composée de la couche de Henle, de la couche de Huxley et de la cuticule au contact du poil et d’une gaine épithéliale externe (Lefort, 2011).
Le follicule pileux a une croissance cyclique séparée en trois phases distinctes, une phase de croissance active durant l’anagène puis un arrêt de l’élongation lors de la catagène. Durant cette phase la papille dermique est remaniée et la matrice extracellulaire maintenant le poil est
dégradée. À la fin de la catagène le poil n’est plus maintenu et repose dans une matrice inerte de kératine. Le follicule pileux entre alors en télogène, il meurt et la papille entre en phase de repos (Prêtre, 2009). Une nouvelle phase d’anagène commence lorsque les cellules souches du bulge (renflement de la gaine épithéliale externe du bulbe pilaire) sont recrutées par la papille pour reformer le nouveau follicule pileux. Ce nouveau follicule va pousser l’ancien poil hors de la gaine fibroconjonctive et le faire tomber.
Figure 13. Schéma d’un follicule pileux normal
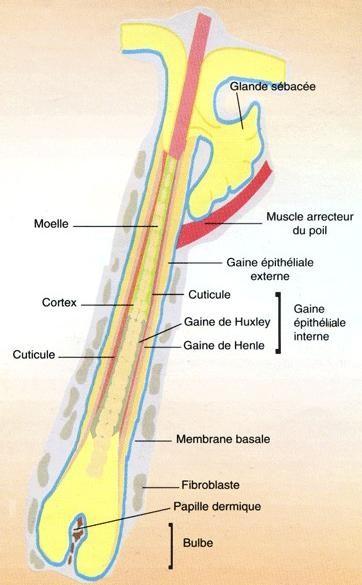
Source : Alhaidari, 1991
Contrairement aux souris sauvages ou hétérozygotes qui commençaient à développer un pelage dense à partir de cinq jours de vie, aucun poil n’était visible à la surface de la peau des mutants homozygotes nudes à l’exception de vibrisses courtes et bouclées (Figure 14).
Figure 14. Phénotype de la souris nude

À gauche : souris hétérozygote nude/+ de 25 jours.
À droite : souris mutante nude/nude de 25 jours, notez l’absence de poils et la présence de fines vibrisses bouclées.
Source : Mecklenburg et al., 2005
L’analyse histologique de la peau des mutants de huit jours, présentée en Figure 15, révélaient un canal pilaire dilaté et contenant des débris cornés ainsi qu’une tige pilaire kératinisée, enroulée sur elle-même et ne traversant pas l’épiderme. En effet, les tiges pilaires se cassaient et se pliaient dès l’entrée dans le canal pilaire où la gaine épithéliale interne n’assurait plus son rôle de support. Les débris cornés provenaient de l’hyperplasie de la gaine épithéliale en réaction à la présence de la tige pilaire dans le canal. Malgré l’absence de pilosité, les bulbes pileux des souris nudes ne présentaient pas d’anomalie (Figure 15 D) et se trouvaient en quantité normale (Mecklenburg et al., 2005, 2001).
Figure 15. Comparaison de la morphologie des follicules pileux des souris nude et sauvage
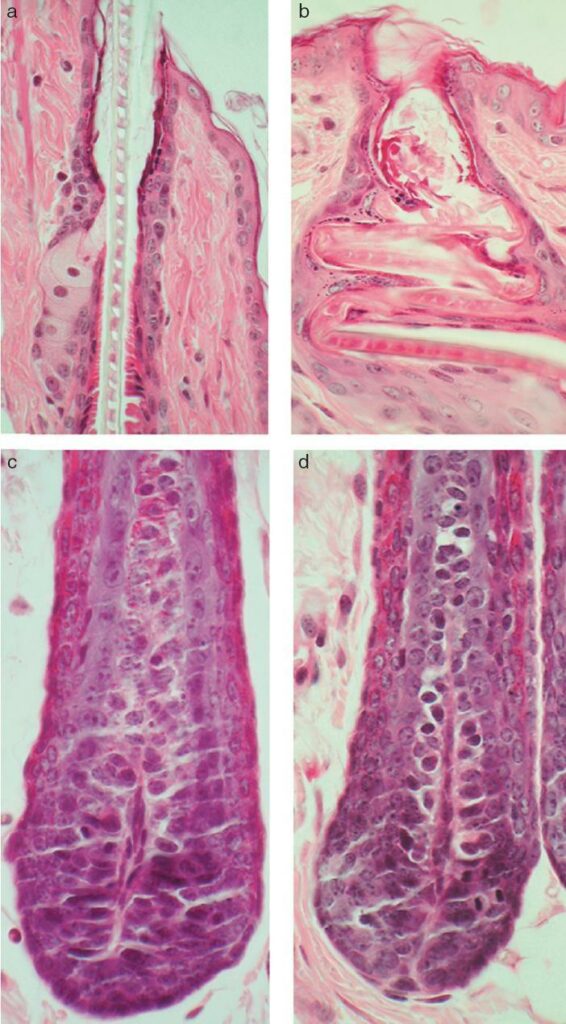
A et C : tige pilaire et bulbe pileux d’une souris de phénotype sauvage.
B et D : tige pilaire et bulbe pileux d’une souris nude, notez l’absence d’anomalie du bulbe pileux et la tige pilaire fracturée et repliée dans le canal pilaire.
Source : Mecklenburg et al., 2005
L’activité cyclique des follicules pileux était conservée chez les souris nudes et Flanagan nota qu’à la 3ème semaine de vie l’épiderme des souris nudes s’affinait, ce qui était cohérent avec l’entrée en phase catagène présentée à ce stade par la peau des souris sauvages. Durant la phase de catagène la papille dermique est remaniée et la matrice extracellulaire maintenant le poil est dégradée, la base du follicule pileux prend alors la forme d’une massue ou d’un club de golf. Chez les souris nudes, le follicule pileux déformé était alors relâché suite à l’élargissement de l’ostium folliculaire, l’infundibulum restant dilaté (Flanagan, 1966). Selon Flanagan les glandes sébacées présentaient des anomalies morphologiques, cependant Mecklenburg expliqua que la présence d’un infundibulum dilaté déplaçait latéralement la glande sébacée alors que celle-ci restait morphologiquement normale (Mecklenburg et al., 2001).
Chez le mutant nude, les anomalies de kératinisation du follicule pileux se traduisaient par une fragmentation des structures globulaires composées de matériel amorphe de la cuticule de la gaine épithéliale interne, ainsi que du cortex et de la cuticule du follicule pileux. Cependant les couches de Henle et de Huxley de la gaine épithéliale interne restaient normalement kératinisées. De plus la medulla de la tige pilaire présentait moins de cloisons chez les mutants nudes que chez les individus sauvages (Mecklenburg et al., 2005). Toutes ces anomalies fragilisaient le poil, le rendant moins rigide et favorisant les fractures.
Les souris nudes présentaient également un épiderme épais avec des défauts de kératinisations qui se traduisaient par des kératinocytes de forme anormale formant des couches irrégulières et non jointives dans la couche cornée. De plus les tonofilaments de kératine des desmosomes et hémidesmosomes (structures liant les cellules entre elles) des couches granuleuse et basale étaient plus fins et moins nombreux chez les mutants nudes que chez les individus sauvages. Ces hémidesmosomes, reliant la couche basale de l’épiderme à la membrane basale, étaient placés de façon plus irrégulière et espacée, compromettant l’adhésion épithéliale (Mecklenburg et al., 2005, 2001).
2. Autres anomalies de kératinisation
Les anomalies de kératinisation présentées par la souris nude ne se limitaient pas aux follicules pileux. La langue, le palais, les cavités nasales ou les dents des souris nudes ne présentaient pas d’anomalies visibles au microscope optique, cependant les ongles étaient anormaux. Les griffes des souris nudes étaient courtes (brachyonychie), fragiles et cassantes au niveau de l’hyponychium (épiderme situé sous le bord libre de l’ongle), laissant une extrémité émoussée. Les écailles formant l’ongle apparaissaient plus petites et allongées que celles des souris sauvages, elles montraient également une bordure dentelée et une surface irrégulière (Mecklenburg et al., 2004).
3. Dysgénésie du thymus à un stade précoce de l’embryogénèse et anomalies des autres tissus lymphoïdes
En 1968, Pantelouris fut le premier à évoquer l’absence de thymus chez les homozygotes mutés des deux sexes. Il rapporta également que le taux de leucocytes circulants était bas chez les porteurs hétérozygotes de la mutation (Pantelouris, 1968). En réalité les souris nudes possédaient un rudiment de thymus de petite taille, composé d’une paire de fins cordons tissulaires ciliés présentant chacun une étroite lumière centrale. Ces cordons s’épaississaient et devenaient vésiculeux au cours du développement mais aucune cellules lymphoïdes ne venaient les occuper (Pantelouris et Hair, 1970).
Lors de l’embryogénèse, le thymus dérive normalement du 3ème arc branchial ou arc pharyngé (Figure 16). Il a une origine mixte, la medulla centrale provenant de la poche endodermique et le cortex périphérique de la fente ectodermique.
Chez les souris sauvages il a été montré que l’endoderme de la 3ème poche branchiale rejoignait l’ectoderme du 3ème arc durant le 9ème jour d’embryogénèse puis l’ectoderme du 2ème arc branchial proliférait et recouvrait les 2ème et 3ème arcs branchiaux pour former le sinus cervical. Le jour suivant l’ectoderme du 3ème arc, au contact de l’endoderme, commençait à proliférer caudo-dorsalement et à se détacher pour former la vésicule cervicale. Au 12ème jour l’ébauche thymique est enfin formée à partir de l’ectoderme et de l’endoderme du 3ème arc branchial. Chez la souris nude, le 3ème arc se développait normalement pour former la vésicule cervicale jusqu’au 11ème jour, c’est alors que l’ectoderme arrêtait son développement et involuait. L’absence de contact avec l’ectoderme empêchait la différentiation de l’endoderme et l’acquisition de la capacité à attirer les cellules souches lymphoïdes par l’ébauche de thymus (Cordier et Haumont, 1980 ; Cordier et Heremans, 1975). Les parathyroïdes provenant de la partie crâniale de la poche branchiale (endoderme) étaient normalement présentes chez les souris nudes, comme la mandibule et la thyroïde, indiquant que le troisième arc branchial n’était pas affecté en totalité (Pantelouris et Hair, 1970).
Figure 16. Schéma du développement du 3ème arc branchial chez une souris sauvage et une souris homozygotes nude/nude
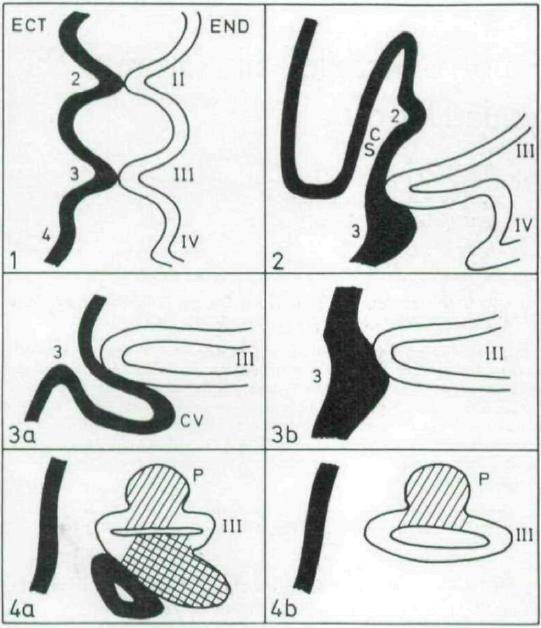
En noir : l’ectoderme noté ECT ; en blanc : l’endoderme noté END.
II à IV : poches branchiales ; 2 à 4 : fentes branchiales ; CS : vésicule cervicale ; P : parathyroïdes.
Figure 1 : 9ème jour de développement ; figure 2 : 10ème jour de développement ; figure 3 : 11ème jour (a : souris sauvage, b : souris nude) ; figure 4 : 12ème jour (a : souris sauvage, b : souris nude).
Source : Cordier et Heremans, 1975
À la naissance l’ébauche thymique, formée depuis le 11ème jour de développement, était une petite structure lobulée composée de cellules épithéliales cylindriques ciliées organisées en kystes et en tubules (Pantelouris et Hair, 1970). Les cellules présentaient un cytoplasme spumeux clair avec de larges vacuoles contenant un matériel prenant la coloration PAS ( Periodic Acid Schiff) et un gros noyau avec un nucléole proéminent (Owen et al., 1975). Ces cellules ciliées étaient retrouvées dans tous les dérivés de l’endoblaste des arc pharyngés, tel que la thyroïde, cela indiquait que la dysgénèsie du thymus ne proviendrait pas d’une anomalie de l’endoblaste (Cordier, 1975). Les larges cellules basophiles ainsi que les cellules lymphoïdes normalement présentes dans le thymus étaient absentes.
Les nœuds lymphatiques des souris nude/nude étaient de taille normale, cependant les lymphocytes étaient pratiquement absents du paracortex thymo-dépendant. Le cortex, les centres germinatifs ainsi que la medulla restaient normaux. Les plaques de Peyer des souris nudes montraient également un sévère déficit en lymphocytes des zones thymo-dépendantes alors que les follicules des lymphocytes B étaient bien présents. L’organisation de la rate était normale chez les souris homozygotes sauvages et hétérozygotes mutées, la pulpe blanche était composée d’une zone thymo-dépendante ou manteau lymphatique péri-artériel directement au contact de l’artériole, de follicules germinaux de lymphocytes B et d’une zone marginale riche en macrophages. Dans la rate des souris homozygotes nude/nude la proportion de pulpe blanche était diminuée, les corpuscules de Malpighi étaient moins nombreux et on notait un appauvrissement du manteau péri-vasculaire en lymphocytes T (De Sousa et al., 1969).
Le taux de lymphocytes circulant était jusqu’à six fois plus faible chez les souris mutantes que chez les souris sauvages, de plus on retrouvait entre 97 % et 100 % de lymphocytes B. Certains auteurs ont rapporté des taux d’immunoglobulines G et A diminués chez les souris nudes alors que le taux d’immunoglobulines M restait normal (Pantelouris, 1973 ; Wortis, 1971).
4. Anomalies du système endocrinien et de l’appareil reproducteur
La mutation nude affectait également le système reproducteur, en effet 30 % des souris nudes étaient infertiles. Les anomalies étaient identiques à celles retrouvées chez les souris ayant subie une thymectomie à l’âge de trois jours : les femelles présentaient de petits ovaires avec peu d’ovocytes et sans corps jaunes et les mâles, des spermatozoïdes peu mobiles. Cependant une greffe de thymus a permis de restaurer la fertilité des souris nudes et d’obtenir des portées de parents nude/nude (Pantelouris, 1973). Les taux sériques d’hormones sexuelles étaient également anormaux, les taux d’œstradiol et de progestérone étaient significativement plus bas chez les souris nudes que chez les souris sauvages de même âge et au même stade de leur cycle (Köpf-Maier et Mboneko, 1990).
Au contraire du thymus, la glande thyroïde des souris nudes était structurellement normale. Cependant le taux sérique en thyroxine (T4) était jusqu’à 50 % plus bas chez les souris nu/nu pour un taux de triiodothyronine (T3) identique (Köpf-Maier et Mboneko, 1990). Un élargissement de la zone réticulée des glandes surrénales des jeunes souris nudes a également été rapporté ainsi qu’une altération des zones glomérulée et réticulée à l’âge de trois mois. (Pierpaoli et Sorkin, 1972).
Les désordres hormonaux mesurés étaient suffisamment importants pour entraîner des désordres métaboliques et l’infertilité des femelles nude/nude était probablement secondaire à la diminution des taux sériques en hormones sexuelles. De plus les souris nudes nécessitaient une température du nid plus élevée, cela a été attribué à la perte de chaleur par rayonnement de leur peau nue mais pouvait également être du à leur taux de T4 sérique faible (Köpf-Maier et Mboneko, 1990).
5. Modification du profil lipidique de la peau
Il a été montré que les souris nudes présentaient un profil lipidique cutané différent de celui des souris BALB/c. Une augmentation de 40 % de la concentration en sulfate de cholestérol a été observée chez les souris nudes. Celui-ci est synthétisé dans la stratum granulosum puis hydrolysé dans la stratum corneum lors de la desquamation des cornéocytes. Les taux de céramides à longues et très longues chaînes et le taux de phospholipides étaient également augmentés chez les souris nudes. Ce sont des constituants majeurs de la stratum corneum responsables de l’imperméabilité de l’épiderme. Les céramides jouent également un rôle dans l’inhibition de la prolifération des kératinocytes, favorisant ainsi leur différenciation. Les acides gras à longues chaînes, issus de l’hydrolyse de phospholipides et triglycérides, limitent l’augmentation du pH de la stratum corneum qui pourrait entraîner une perte d’imperméabilité et une augmentation de la desquamation par activation des protéases. Trois de ces acides gras (C21:0, C22:1 et C24:1), étaient augmentés chez les souris nudes. On a également observé une diminution de la concentration en triglycérides. Celle-ci pourrait être secondaire à leur utilisation pour la formation des acides gras, céramides et phospholipides (Lanzini et al., 2015).
C- Le locus nude chez la souris
Le locus nude chez la souris a été localisé sur le chromosome 11 (Takahashi et al., 1992), ses huit exons codent pour une protéine de 648 acides aminés présentant des homologies avec les facteurs de transcription winged-helix, le locus pris alors le nom de winged-helix nude (whn). La protéine issue du locus nude ou whn possédait un site de liaison à l’ADN, riche en proline et en acides aminés chargés négativement, compatible avec un domaine winged-helix (Nehls et al., 1994 ; Segre et al., 1995). Suite à la mise en place d’une nouvelle nomenclature unifiée pour les facteurs de transcriptions winged-helix, le gène whn a pris le nom de FOXN1 pour Forkhead Box N1 (Kaestner et al., 2000). Sept mutations spontanées du gène FOXN1 ont été répertoriées chez la souris (Tableau 4), toutes produisant un phénotype nu avec une agénésie du thymus (Mecklenburg et al., 2005 ; « Mouse Genome Informatics », 2015).
Tableau 4 : Récapitulatif des allèles du gène FOXN1 issus de mutations spontanées
Nom et symbole de l’allèle
Mutation
Protéine obtenue
Nude FOXN1nu
Délétion d’un nucléotide (G) dans l’exon 3 introduisant un codon stop.
Protéine tronquée sans domaine de liaison à l’ADN
Nude 2 Jackson FOXN1nu-2J
Délétion de 7 nucléotides dans l’exon 3.
Introduction de 186 acides aminés supplémentaires en position 114 et d’un codon stop dans le domaine de liaison à l’ADN.
Nude British- Colombia FOXN1nu-Bc
Insertion d’un transposon de plus de 5500pb entre les exons 1b et 2. Insertion d’un codon stop en amont d’un codon d’initiation.
Protéine tronquée non fonctionnelle.
Nude Saint Louis FOXN1nu-Stl
Insertion de 2pb dans l’exon 7.
Protéine tronquée sans domaine d’activation.
Nude Yurlovo FOXN1nu-Y
Mutation faux sens d’une paire de base du nucléotide 1051 dans l’exon 7.
Remplacement de l’arginine en position 320 par une cystéine. Protéine complète mais inactive.
Traveling Wave FOXN1tw
Epissage anormal de l’exon 7.
Protéine tronquée, domaine de liaison à l’ADN manquant.
Nude Streaker FOXN1nu-str
Absence d’information.
Absence d’information.
Source : Mouse Genome Informatics , 2015
Neuf mutations ciblées du gène FOXN1 ont également été créées lors de l’étude du locus nude (Tableau 5), toutes présentaient un phénotype nude à l’exception de la mutation Nancy R Manley FOXN1tm2Nrm (Mecklenburg et al., 2005).
Nom et symbole de l’allèle
Mutation
Protéine obtenue
Alexander Y Rudensky FOXN1tm1(cre)Ayr
Insertion d’un site de recombinaison LoxP-Cre (recombinase spécifique de site de type Cre) dans une séquence IRES (internal ribosome entry site).
Absence d’information.
Clare Blackburn FOXN1tm1.1Cbln
Insertion d’une séquence LoxP-Cre, d’un accepteur d’épissage, d’une cassette neo (gène de résistance à la néomycine) et d’une cassette blasticydine dans l’intron 1b.
Allèle hypomorphe.
Dong-Ming Su FOXN1tm1Dmsu
Insertion d’un site de recombinaison LoxP-Cre en amont de l’exon 5 et d’un site de recombinaison FRT ( recombinase spécifique de site de type flipase) avec une cassette neo en aval de l’exon 6.
Nancy R Manley FOXN1tm1Nrm
Insertion d’une séquence GFP (green fluorescent protein) dans l’exon 3 entraînant un épissage aberrant.
Protéine tronquée de 154 acides aminés à l’extrémité N-term. Les domaines d’activation et de liaison à l’ADN sont présents et fonctionnels à l’extrémité C-term.
Thomas Boehm FOXN1tm1Tbo
Insertion d’une cassette IRES-βgalactosidase- neo dans l’exon 3.
Inactivation du gène.
Nancy R Manley 2 FOXN1tm2Nrm
Insertion d’une cassette IRES-lacZ et d’un site de recombinaison FRT (ou LoxP) avec une cassette neo en 3’ de l’exon 9.
Thomas Boehm 2 FOXN1tm2Tbo
Insertion d’un site de recombinaison LoxP avec une cassette de deux séquences de 605pb avec des sites accepteurs d’épissage, un signal polyA et un gène de résistance à l’hygromycine.
Nancy R Manley 3 FOXN1tm3Nrm
Insertion d’une cassette IRES-neo en 3’ de l’exon 9.
Source : Mouse Genome Informatics , 2015
Plusieurs tentatives d’insertion d’un transgène ont visé à restaurer un phénotype normal dans des lignées nudes. L’utilisation d’un cosmide contenant les 8 exons de l’allèle sauvage du gène FOXN1 n’a permis qu’une restauration partielle du phénotype sauvage chez des souris nudes, en effet les souris montraient une légère pousse de poil mais pas de développement d’un thymus normal (Kurooka et al., 1996). En 2002, l’utilisation d’un transgène de 110 kilobases comprenant le gène FOXN1 sauvage a permis le développement d’un pelage et d’une population de lymphocytes T chez des souris nudes et donc la restauration d’un phénotype sauvage (Cunliffe et al., 2002).
D- Le gène FOXN1 code un facteur de transcription winged-helix/forkhead
Il a été montré que FOXN1 faisait partie d’une grande famille de facteurs de transcription d’importance majeure dont la structure a été conservée durant l’évolution. Plus de 2000 facteurs FOX ont été identifiés chez plus de 108 espèces animales ; ils ont également été retrouvés chez des champignons (Benayoun et al., 2011).
Le rôle charnière des facteurs de transcription FOX est illustré par la gravité des phénotypes associés aux mutations touchant un gène FOX, comme le montraient les lignées nudes. En effet il a été montré qu’ils jouaient un rôle clé dans la détermination et la différenciation de certains types cellulaires durant le développement embryonnaire. L’expression de ces facteurs est souvent limitée à un seul type de cellule dans lequel ils interviennent au sein de voies de transduction d’importance majeure, en particulier la cascade TGF-β, la voie Sonic-Hedgehog (SHH) ou encore la voie Wnt/β-caténine (Benayoun et al., 2011).
Les facteurs de transcription FOX ont en commun un domaine Forkhead (FHD) comprenant trois hélices α N-terminales (H1 à 3), trois feuillets β ainsi que deux boucles ou « ailes » (W1 et 2) en région C-terminale (Figure 17). L’association des boucles et des hélices a inspiré la première nomenclature en winged-helix en raison de la ressemblance avec des ailes de papillon (Benayoun et al., 2011).
Figure 17. Structure 3D du domaine Forkhead conservé dans la famille des facteurs de transcription FOX
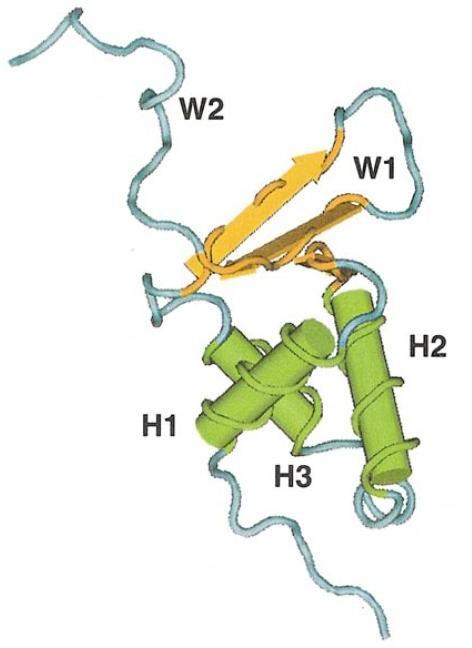
H1 à 3 en vert : hélices α ; W1 et 2 : Boucles ; en jaune : feuillets β.
Source : Benayoun et al., 2011
La liaison avec l’ADN est assurée par l’hélice H3, ou hélice de reconnaissance, qui reconnaît une séquence consensus de sept nucléotides. Le facteur FOX se lie alors sous la forme de monomère sur la grande hélice de l’ADN. La spécificité de la liaison entre la protéine FOX et l’ADN dépend également d’une région variable se trouvant entre les hélices H2 et H3 et les boucles W1 et W2, cette région interagit avec la petite hélice de l’ADN (Carlsson et Mahlapuu, 2002).
En tant que facteur de transcription, les protéines de la famille FOX possèdent des signaux de localisation nucléaire (SLN) aux extrémités N et C terminales dans l’hélice H1 et la boucle W2. Les protéines portant de tels signaux sont reconnues par la protéine importine dans le cytosol et guidées vers les pores nucléaires. Le SLN de la boucle W2 en C-terminal est une séquence, riche en acides aminés basiques et caractéristique des séquences SLN, très conservées au sein de la famille FOX alors qu’il a été montré que le SLN en N-terminal n’était pas toujours retrouvé (Benayoun et al., 2011).
Au contraire de la forte homologie retrouvée au sein des domaines de liaisons à l’ADN de la famille FOX, il a été montré que les domaines d’activation et de répression présentaient une très grande variabilité. La protéine FOXN1 possédait un domaine d’activation de la transcription situé en C-terminal, une séquence typique riche en acides aminés acides ou
« acidic blob » (Schüddekopf et al., 1996).
Il a été mis en évidence que les histones de liaison H1 et H5 présentaient un domaine très similaire au FHD composé d’une hélice, d’une boucle et d’un feuillet. Cette similarité suggérait que les facteurs FOX posséderaient la possibilité de promouvoir directement l’activité d’un gène en agissant directement sur le degré d’exposition de la chromatine et pas seulement par interaction avec des domaines d’activation de la transcription (Carlsson et Mahlapuu, 2002).
E- Le locus nude des mammifères
1. Chez le chat Sacré de Birmanie
Le gène FOXN1 du chat sous sa forme sauvage a été localisé sur le chromosome E1. Il présente 1944 paires de bases (pb) donnant une protéine de 647 acides aminés pour un poids moléculaire de 68 563,57 Dalton (« Ensembl », 2015). La protéine FOXN1 du chat présente un très fort degré d’homologie avec celle de la souris avec plus de 87 % de similarité, cette homologie était maximale au niveau du domaine Forkhead (99 %) et du domaine d’activation en C-terminal (98 %).
Il a été mis en évidence que la délétion de 4 pb identifiée au sein de l’exon 6 du gène FOXN1 des chats Sacré de Birmanie porteurs de la mutation de nudité provoquait un changement dans le cadre de lecture et une perte de la structure du domaine Forkhead. Cette perte de structure se traduisait par l’absence d’un feuillet β et de la boucle W2 du domaine FHD et était responsable de la perte de fonction du domaine en raison de l’incapacité à se lier à l’ADN.
De plus, l’apparition d’un codon stop prématuré entraînait la formation d’une protéine amputée d’une partie du domaine d’activation C-terminal, seuls 6 acides aminés sur 54 étaient conservés (identiques à la séquence normale) dans la séquence et les 15 derniers acides aminés étaient absents. En l’absence de ses domaines fonctionnels (domaine de liaison à l’ADN et domaine d’activation en C-terminal) la protéine FOXN1 ne pouvait remplir son rôle (Abitbol et al., 2015).
La mutation a été recherchée chez 215 chats de quinze autres races que Birman et n’a pas été retrouvée, mais elle était présente chez 3,2% des 126 Birmans recrutés dans l’étude. La délétion n’ayant pas été observée chez les races utilisées pour créer la race Sacré de Birmanie (Persan, Siamois et Orientaux), il était probable qu’elle soit apparue entre les années 1920 et 1977, après la création de la race Birman (Abitbol et al., 2015).
Un test génétique est proposé par le laboratoire Antagene depuis la découverte de la mutation causale du syndrome de nudité du Sacré de Birmanie. Ce test permet aux éleveurs de dépister les individus porteurs de la mutation et de réaliser des accouplements raisonnés en cas de reproducteurs hétérozygotes. Réalisé par le vétérinaire de manière non-invasive à l’aide d’un écouvillon buccal, le génotypage a son résultat connu sous quelques jours ( Antagene, 2015).
2. Chez les animaux de laboratoire
Le phénotype nude a également été retrouvé chez le rat : ces animaux présentaient les mêmes caractéristiques phénotypiques que les souris nudes à savoir une nudité et une immunodéficience sévère. Le gène responsable de ce phénotype chez le rat a été localisé sur le chromosome 10 et la région présentait une forte homologie en terme de séquence et d’organisation avec la région du locus nude de la souris (Cash et al., 1993).
Une mutation non-sens a été mise en évidence à la 1429 pb du gène rnu (rat-nude = FOXN1) chez le rat, cette mutation aboutissait à la formation d’une protéine non fonctionnelle (Segre et al., 1995).
3. Chez l’homme
Le syndrome de nudité de la souris a longtemps été comparé avec différents cas d’aplasie thymique chez l’homme, en particulier avec le syndrome de DiGiorge. Celui-ci provoque une aplasie totale du thymus mais également des autres composants issus du troisième arc branchial dont les parathyroïdes, la thyroïde et la mandibule, qui ne sont pas affectés chez les souris nudes (De Sousa et al., 1969 ; Pantelouris et Hair, 1970).
Un syndrome similaire au syndrome nude a été observé dans un village isolé d’Italie, Acerno. Les deux sœurs étudiées présentaient une alopécie congénitale et une dystrophie des ongles associées à une immunodéficience sévère. De plus aucun thymus n’a été observé sur les radiographies réalisées. La plus âgée est décédée prématurément à l’âge de 12 mois des suites d’infections récurrentes et à l’âge de 5 mois la plus jeune a reçu une greffe de moelle osseuse permettant une restauration complète des fonctions immunitaires mais sans modification de son aspect physique (Pignata et al., 1996).
De l’ADN a été prélevé sur des membres de la famille des deux sœurs et l’analyse du gène FOXN1 sur le chromosome 17 a mis en évidence une mutation non-sens en position 255 dans la protéine, au niveau de l’exon 5 du gène (R255X) conduisant à une protéine non fonctionnelle (Frank et al., 1999). Une étude réalisée en 2004 au sein du village d’Acerno a mis en évidence trois haplotypes portant la mutation et a révélé que 6,52 % de la population était porteuse à l’état hétérozygote de la mutation. Un couple d’ancêtres communs du début du 19ème siècle a été identifié (Adriani et al., 2004). Une campagne de consultations de génétique avec diagnostic pré-natal a été mise en place au sein du village en raison de la gravité du syndrome. En effet un cas de malformation sévère du tube neural a été observé chez un fœtus portant la mutation R255X, suggérant que le phénotype nude chez l’homme serait plus grave que celui de la souris (Amorosi et al., 2008).
Arbres généalogiques
Les informations des arbres généalogiques émis par le LOOF et celles trouvées sur les sites dédiés à la généalogie des Sacré de Birmanie ont permis de construire l’arbre généalogique des chatons atteints du syndrome de nudité (Figure 23).
Un couple d’ancêtres communs a pu être identifié, ces chats sont nés respectivement en 1959 et 1961 et sont à l’origine des lignées au sein desquelles des chatons atteints ont été observés. Ces deux chats sont issus des croisements réalisés à partir des Birmans survivants de la Seconde Guerre Mondiale (Figure 24) qui sont les fondateurs de la race Sacré de Birmanie telle qu’elle est connue actuellement. On peut noter sur l’arbre de la Figure 24, l’introduction de chats issus de croisements avec des chats de race Persan ainsi que la présence d’un chat Siamois ganté dans l’arbre. Les nombreux croisements consanguins observés ont permis de sélectionner et de fixer les caractéristiques du Sacré de Birmanie, en particulier la présence des gants.
Les symboles utilisés dans les Figure 23 et Figure 24 sont les suivants :
Les femelles sont représentées par des cercles, les mâles par des carrés. Les chatons atteints du syndrome de nudité sont représentés par un symbole plein, les chats hétérozygotes pour la mutation par un symbole bicolore. Les chats décédés sont rayés d’un trait. Les chats dont le génotype est connu sont représentés en bleu, les chats suspects d’être porteurs de la mutation avec un symbole « ? ». Les symboles des ancêtres communs sont roses et leurs dates de naissance sont indiquées.
Figure 23. Arbre généalogique de chats Sacré de Birmanie porteurs de la mutation responsable du syndrome de nudité.
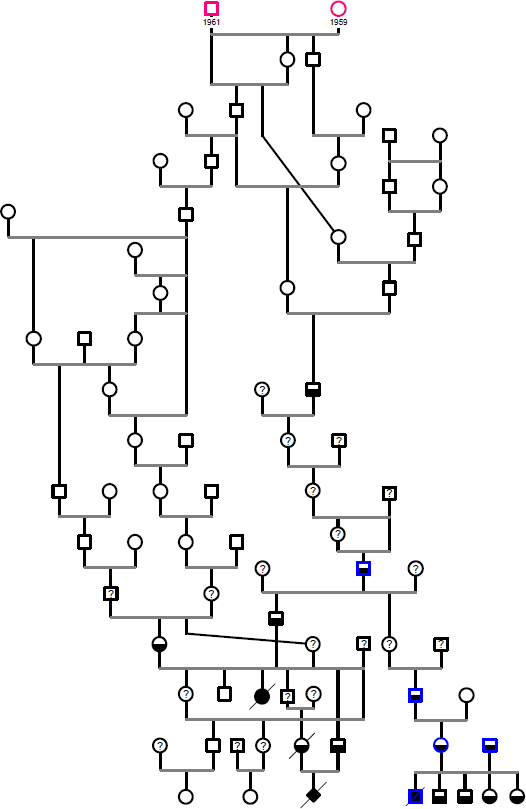
Figure 24. Arbre généalogique des ancêtres communs des chatons porteurs de la mutation de nudité
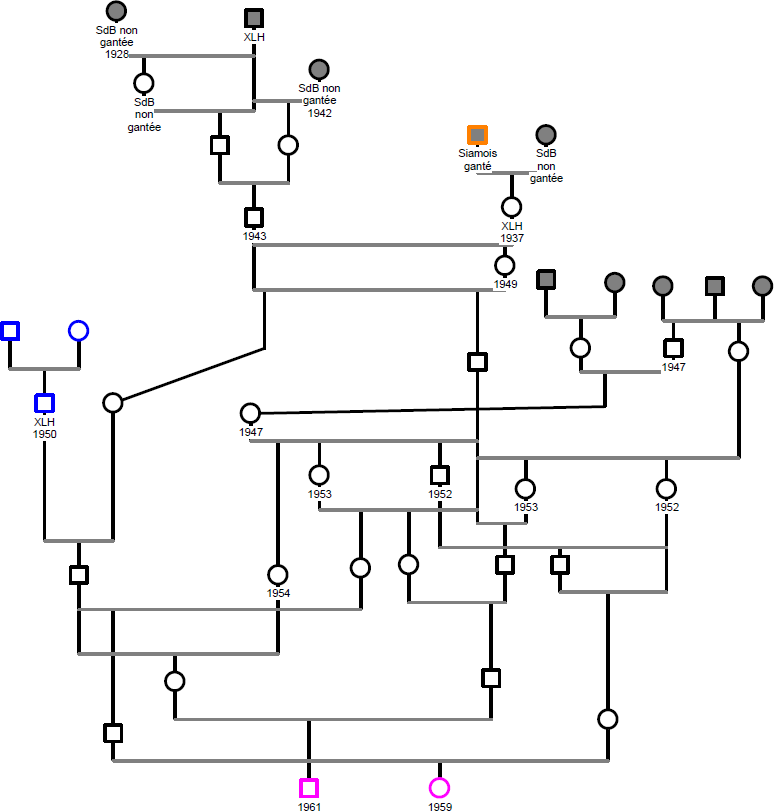
On retrouve en rose le couple d’ancêtres communs identifié dans la Figure 23.
Les chats notés XLH sont des chats inscrits au registre en tant que croisement inter-races mais ayant le phénotype de la race visée, ici le Sacré de Birmanie (SdB).
En bleu sont représentés les chats issus de croisements avec le Persan et en orange le Siamois.
Les chats fondateurs de la race sont représentés avec des symboles grisés, certaines caractéristiques physiques et années de naissance ont également été indiquées.
Conclusion
Le syndrome de nudité du Sacré de Birmanie est un syndrome associant une alopécie et une mortalité précoce due à un déficit immunitaire secondaire à la dysgénésie du thymus. Une délétion de quatre paires de bases dans l’exon 6 du gène FOXN1 a été identifiée comme étant la mutation causale. Elle provoque un décalage du cadre de lecture avec l’arrivée prématurée d’un codon STOP et la formation d’une protéine tronquée non fonctionnelle. Un syndrome semblable est connu chez la souris, il est causé par la mutation nude qui affecte également le gène FOXN1. La similarité entre le phénotype des chatons atteints du syndrome de nudité et celui des souris nudes ainsi que la présence d’une mutation causale dans le même gène, nous permet de parler de Birmans nudes.
Le facteur de transcription FOXN1 appartient à une famille protéique, très conservée durant l’évolution, partageant un domaine de liaison à l’ADN en winged-helix appelé domaine Forkhead (FHD). Chez les birmans nudes, il a été prédit que la délétion compromettait la structure du domaine FHD et amputait une partie du domaine d’activation C-terminal de FOXN1.
FOXN1 est un facteur de transcription clé de la différenciation embryonnaire de l’épiderme et de l’épithélium thymique. Il est également essentiel au maintien de la structure tridimensionnelle du thymus, nécessaire au bon déroulement de la lymphopoïèse thymique. Immunodéprimées, les souris nudes sont des modèles largement utilisés et très demandés en recherche. Les Sacré de Birmanie nudes pourraient être, à l’avenir, un nouveau modèle utilisé pour des recherches au plus long terme ; cependant des considérations éthiques et économiques sont à prendre en compte avant toute utilisation de ce chat comme modèle.
L’observation d’un cas de syndrome de nudité chez un chaton européen (muté pour FOXN1) a posé la question de l’origine génétique de la mutation. L’analyse des arbres généalogiques de chats Birmans et des l’haplotypes formés des allèles des SNPs entourant la mutation, a fait fortement suspecter une origine birmane à la mutation nude féline (mutation apparue au sein de la race Sacré de Birmanie). Cependant des études complémentaires seront nécessaires pour confirmer cette hypothèse, qui devront inclure des marqueurs supplémentaires et une cohorte plus grande de chats pour préciser définitivement l’origine de la mutation nude du Birman.
Source thèse Charlotte Marie Isabelle BINEAU – 2016
LE BOIS DE L'EPOT
18360 SAINT VITTE
06.61.87.48.53
association@birmania-and-co.com
Retrouvez-nous sur Facebook
Club de race au LOOF
Association loi 1901 crée le 22/4/06 | JO du 3/6/06 n° 20060022-1568
Site déclaré à la CNIL le 27/04/2006, n° 1165444
Le site de BIRMANIA AND CO appartient et est géré par BIRMANIA AND CO MAG • Site créé en 05/2005 | Refonte en 03/2023 par Heavncha Studio
